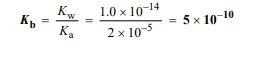LATIHAN DAN KUIS CHAPTER 19 - 25
LATIHAN :
Chapter 19
Tuliskan persamaan setimbang reaksi nuklir 5626 Fe(d, α) 5425 Mn, di mana d mewakili inti deuterium (yaitu, 21H).
Jawab:
Singkatan tersebut memberi tahu kita bahwa ketika besi-56 dibombardir dengan inti deuterium, ia menghasilkan inti mangan-54 ditambah sebuah partikel α. Jadi, persamaan reaksi ini adalah
5626 Fe + 21H à 42 α + 5425 Mn
Chapter 20
Entalpi ikatan O2 adalah 498,7 kJ / mol. Hitung panjang gelombang maksimum (nm) foton yang dapat menyebabkan disosiasi molekul O2.
Jawab:
Pertama kita menghitung energi yang dibutuhkan untuk memutus satu ikatan O=O:
(498,7 x 103 J /1 mol) x (1 mol/6,022 x1023) molekul = 8,281 x 1019 J/molekul
Energi foton diberikan oleh E = hv [Persamaan (7.2)]. Karena itu,
v =E/h =8.281 x 10-19 J/ 6.63 x 10-34 J. s = 1.25 x 1015 s-1
Akhirnya, kami menghitung panjang gelombang foton, yang diberikan oleh λ= c / v [lihat Persamaan (7.1)], sebagai berikut:
λ =(3.00 x 108 m/s) / 1.25 x 1015 s-1 = 2.40 x 10-7 m = 240 nm
Chapter 21
Dengan proses Hall, berapa jam yang dibutuhkan menyimpan 664 g Al pada arus 32,6 A?
Jawab:
Reaksi reduksinya yaitu :Al3+(aq) + 3e- → Al(s)
Pertama, kita dapat menghitung jumlah yang dibutuhkan untuk menyetor 664 g Al
Karena arus satu ampere mewakili aliran satu coulomb per detik, kita dapat mengetahui waktu yang dibutuhkan untuk itu melewati jumlah biaya ini.

Chapter 22
Tanpa mengacu pada Gambar 22.1, nyatakan apakah masing-masing unsur berikut adalah logam, metaloid, atau bukan logam: (a) Cs, (b) Ge, (c) I, (d) Kr, (e) W, (f) Ga , (g) Te, (h) Bi.
Jawab :
a) Cs: Metal
b) Ge: Metaloid
c) I: Non-metal
d) Kr: Non-metal
e) W: Metal
f) Ga: Metaloid
g) Te: Metal
h) Bi: Metal
Chapter 23
Tuliskan bilangan oksidasi logam dalam senyawa K[Au(OH)4].
Jawab :
Bilangan oksidasi logam bergantung pada ligan yang terikat ke pusat logam. Pusat emas memiliki empat ligan OH terikat, yang masing-masing membawa muatan -1. Kalium membawa muatan +1. Ini berarti pusat Au berada dalam bilangan oksidasi +3.
4(-1) + 1(1) = -3
Chapter 24
Derajat keasaman dari larutan 100 ml H2SO4 0,02 M adalah
Jawab :
H2SO4 merupakan asam kuat, bervalensi 2
[H+] = Ma x Val
= 0,02 x 2 = 4 x 10-2
pH = -log 4 X 10-2
= 2-log 4
Chapter 25
Berapakah konsentrasi ion [OH–] dalam larutan jika konsentrasi H+ = 2 X 10-4 M (Diketahui Kw = 10-14)…….
Jawab :
Dalam larutan dengan pelarut air, berlaku :
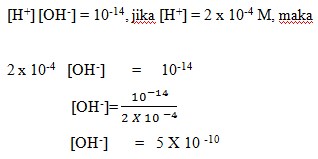
KUIS :
Chapter 19
Mengapa rangkaian peluruhan radioaktif mengikuti kinetika orde pertama?
Jawab:
Deret peluruhan radioaktif mematuhi kinetika orde satu dan laju peluruhan radioaktif setiap t diberikan.
Nilai pada saat t = λN
Dimana λ laju orde satu konstan dan N adalah jumlah inti radioaktif yang ada pada waktu t. reaksi peluruhan radioaktif bergantung pada hukum kekekalan energi dan momentum.
Chapter 20
Gambarkan struktur Lewis untuk klorin nitrat (ClONO2) dan klorin monoksida (ClO).
Jawab:
Struktur Lewis untuk klorin nitrat (ClONO2) dan (ClO) klorin monoksida.
Chapter 21
Tulis persamaan yang seimbang untuk masing-masing berikut ini reaksi: (a) natrium bereaksi dengan air; (b) larutan NaOH bereaksi dengan CO2; (c) padat Na2CO3 bereaksi dengan larutan HCl; (d) NaHCO3 padat bereaksi dengan larutan HCl; (e) NaHCO3 padat adalah dipanaskan; (f) Na2CO3 padat dipanaskan.
Jawab:
(a) 2Na(s) + 2H2O(l) ⎯⎯→ 2NaOH(aq) + H2(g)
(b) 2NaOH(aq) + CO2(g) ⎯⎯→ Na2CO3(aq) + H2O(l)
(c) Na2CO3(s) + 2HCl(aq) ⎯⎯→ 2NaCl(aq) + CO2(g) + H2O(l)
(d) NaHCO3(aq) + HCl(aq) ⎯⎯→ NaCl(aq) + CO2(g) + H2O(l)
(e) 2NaHCO3(s) ⎯⎯→ Na2CO3(s) + CO2(g) + H2O(g)
(f) Na2CO3(s) ⎯⎯→tidak terjadi reaksi,Tidak seperti CaCO3 (s), Na2CO3 (s) tidak terurai dengan pemanasan sedang
Chapter 22
Karbon biasanya diklasifikasikan sebagai bukan logam. Namun, grafit yang digunakan dalam pensil "timah" menghantarkan listrik. Lihat pensil dan buat daftar dua sifat grafit bukan logam.
Jawab:
Sifat bukan logam dari grafit
(a) Grafit tidak dapat dibentuk atau ulet
(b) Grafit tidak menghasilkan suara nyaring saat dipukul dengan palu
Chapter 23
Asam oksalat, H2C2O4, terkadang digunakan untuk membersihkan noda karat dari bak cuci dan bak mandi. Jelaskan bahan kimia yang mendasari tindakan pembersihan ini.
Jawab:
Asam oksalat H2C2O4 adalah ligan bidentate yang digunakan untuk membersihkan noda karat dari wastafel dan bak mandi karena ini adalah agen pengkelat yang efektif yang membentuk jalur komposit yang stabil dan dapat larut dengan noda dan membersihkannya dari wastafel dan tab mandi.
Chapter 24
Sebutkan jenis senyawa berikut yang dapat membentuk ikatan hidrogen dengan molekul air: (a) asam karboksilat, (b) alkena, (c) eter, (d) aldehida, (e) alkana, (f) amina.
Jawab:
Ikatan hidrogen adalah jenis gaya dipol-dipol khusus yang ada antara atom elektronegatif dan atom hidrogen yang terikat pada Nitrogen, Oksigen atau Fluor.
Jenis senyawa berikut yang dapat membentuk ikatan hidrogen dengan molekul air adalah
(a) Asam karboksilat (R-COOH)
(b) Aldehida (RCHO)
(c) Amina (RNH2)
(d) Eter (R-O-R)
(e)
Chapter 25
Jelaskan struktur β-lipit yang ada di beberapa protein.
Jawab:
Struktur β-lipit - Dalam jenis struktur sekunder ini, rantai peptida berdampingan secara zig-zag dengan gugus R bergantian di sisi yang sama. Rantai peptida yang berdekatan disatukan oleh ikatan-H antarmolekul yang menghasilkan pembentukan struktur tipe lembaran datar.