Latihan dan Kuis Chapter 13 - 18 :
LATIHAN :
Chapter 13
Tuliskan ekspresi laju untuk reaksi berikut:
Jawab :
· laju penambahan konsentrasi CO2 dan H2O tiap satuan waktu
+[CO2]/t , +[H2O]/t
· laju pengurangan konsentrasi CH4 dan O2 tiap satuan waktu
-[CH4]/t , -[O2]/t
Chapter 14
Tulis Kc dan KP untuk dekomposisi dinitrogen pentoksida:
Jawab :
Kc : [NO2]4[O2] / [N2O5]2
Kp : (P⁴ NO2)(PO2)/(P2N2O5)
Chapter 15
Konsentrasi ion OH- dalam larutan pembersih amonia rumah tangga tertentu adalah
0,0025 M. Hitung konsentrasi ion H1.
Strategi :
Kita diberi konsentrasi ion OH2 dan diminta untuk menghitung [H+]. Hubungan antara [H+] dan [OH-] dalam air atau larutan air diberikan oleh produk-ion air, Kw [Persamaan (15.3)].
Jawab :
Chapter 16
Manakah dari senyawa berikut yang akan lebih larut dalam larutan asam daripada dalam air: (a) CuS, (b) AgCl, (c) PbSO₄?
Strategi :
Dalam setiap kasus, tuliskan reaksi disosiasi garam ke dalam kation dan anionnya. Kation tidak akan berinteraksi dengan ion H⁺ karena keduanya memiliki muatan positif. Anion akan bertindak sebagai akseptor proton hanya jika anion merupakan basa konjugasi dari asam lemah. Bagaimana penghilangan anion mempengaruhi kelarutan garam?
Jawab :
(a) Kesetimbangan kelarutan untuk CuS adalah
CuS(s) ⇋ Cu²⁺(aq) + S²⁻(aq)
Ion sulfida adalah basa konjugasi dari asam lemah HS⁻. Oleh karena itu, ion S²⁻ bereaksi dengan ion H⁺ sebagai berikut:
S²⁻(aq) + H⁺(aq) → HS⁻(aq)
Reaksi ini menghilangkan ion S²⁻ dari larutan. Menurut prinsip Le Châtelier, kesetimbangan akan bergeser ke kanan untuk menggantikan beberapa ion S²⁻ yang dihilangkan, sehingga meningkatkan kelarutan CuS.
(b) Ekuilibrium kelarutan adalah
AgCl(s) ⇋ Ag⁺(aq) + Cl⁼(aq)
Karena Cl⁻ adalah basa konjugasi dari asam kuat (HCl), kelarutan AgCl tidak dipengaruhi oleh larutan asam.
(c) Ekuilibrium kelarutan untuk PbSO₄ adalah
PbSO₄(s) ⇋ Pb²⁺(aq) + SO₄²⁻(aq)
Ion sulfat adalah basa lemah karena merupakan basa konjugasi dari asam lemah HSO₄⁻. Oleh karena itu, ion SO₄²⁻ bereaksi dengan ion H⁺ sebagai berikut:
SO₄²⁻(aq) + H⁺(aq) → HSO₄⁻(aq)
Reaksi ini menghilangkan ion SO₄²⁻ dari larutan. Menurut prinsip Le Châtelier, kesetimbangan akan bergeser ke kanan untuk menggantikan sebagian ion SO₄²⁻ yang dihilangkan, sehingga meningkatkan kelarutan PbSO₄.
Chapter 17
(a) 2H2(g)+O2(g) → 2H2O(l)
(b) NH4Cl (s) → NH3(g)+HCl (g)
(c) H2(g)+Br2(g)→2HBr(g)
Jawab :
(a) Dua molekul reaktif digabungkan untuk membentuk satu molekul produk. Meskipun H2O adalah molekul yang lebih kompleks daripada H2 dan O2, fakta bahwa ada penurunan bersih dari satu molekul dan gas dikonversi ke cairan memastikan bahwa jumlah mikrostates akan berkurang dan karenanya DS° negatif.
Chapter 18
Setarakan persamaan berikut untuk reaksi dalam asam medium dengan metode ion-elektron:
Jawab:
Fe^2+ + MnO4^- → Fe^3+ + Mn^2+ (Asam)
+2 +7 +3 +2
perubahan biloks Fe = 1 × 5
perubahan biloks Mn = 5 × 1
awal: 5 Fe^2+ + MnO4^- → 5 Fe^3+ + Mn^2+
setara : 5 Fe^2+ + MnO4^- + 8 H^+ → 5 Fe^3+ + Mn^2+ + 4 H2O
KUIS ;
Chapter 13
Konstanta kesetimbangan berikut telah ditentukan untuk asam hidrosulfurat pada 25 ° C:
Hitung konstanta kesetimbangan untuk reaksi berikut pada suhu yang sama:
Konstanta kesetimbangan untuk reaksi keseluruhan adalah
Chapter 14
Tulis Kc dan KP untuk dekomposisi dinitrogen pentoksida:
Jawab :
Kc : [NO2]4[O2] / [N2O5]2
Kp : (P⁴ NO2)(PO2)/(P2N2O5)
Chapter 15
Identifikasi pasangan asam-basa konjugasi untuk reaksi
Jawab :
Pasangan asam basa konjugasi adalah
H₂O dan OH⁻ atau CN⁻ dan HCN
Prediksi apakah perubahan entropi sistem dalam setiap reaksi berikut adalah positif atau negatif.
(a) 2H2(g)+O2(g) → 2H2O(l)
(b) NH4Cl (s) → NH3(g)+HCl (g)
(c) H2(g)+Br2(g)→2HBr(g)
Jawab :
(a) DS° negatif karena ada penurunan bersih dari satu molekul dan gas dikonversi ke cairan
(b) DS positif karena dari padat dikonversi menjadi dua bentuk gas
(c) DS negatif karena jumlah molekul yang sama terlibat dalam reaktif seperti dalam produk.
Chapter 18
Hitung ggl standar sel yang menggunakan reaksi setengah sel Ag / Ag+ dan Al / Al+3. Tuliskan reaksi sel yang terjadi dalam kondisi keadaan standar.
Jawab:
Esel = EAg – EAl
= 0,8 - (-1,66)
= +2,46
Persamaan: (Oksidasi) Al àAl+3 + 3e-
(Reduksi) Ag+ + e- à Ag

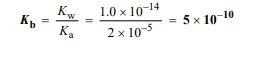




Tidak ada komentar:
Posting Komentar