BAHAN PRESENTASI MATAKULIAH KIMIA
SEMESTER GANJIL TA 2020/2021
DISUSUN OLEH
MAWADDATUR RAHMAH
2010951035
DOSEN PENGAMPU :
Darwison, MT
Eka Putra Waldi. Dr. M.Eng
Referensi :
| Chang, R. and Goldsby, K.A.(2016), Chemistry, Twelfth edition, Mc.Graw-Hill education, Florida State University. |
Tujuan Pembelajaran :
- Mengetahui hubungan antara konstanta ionisasi asam dan basa konjugatnya
- Mengenal asam diprotik dan poliprotik
- Menentukan struktur molekul dan kekuatan asam
- Mengetahui sifat asam-basa dari garam
- Mengetahui sifat asam-basa dari oksida dan hidroksida
- Menentukan asam dan basa lewis
PEMBAHASAN BAB 15 : ASAM DAN BASA (15.7-15.12)
15.7 Hubungan Antara Konstanta Ionisasi Asam dan Basa Konjugatnya
Hubungan penting antara tetapan ionisasi asam dan tetapan ionisasi basa konjugatnya dapat diturunkan sebagai berikut, menggunakan asam asetat sebagai contoh:
Basa konjugasi, CH3COO2, disuplai oleh larutan natrium
asetat (CH3COONa), bereaksi dengan air menurut persamaan

Hasil ini mungkin tampak aneh pada awalnya, tetapi jika kita
menambahkan dua persamaan kita melihat bahwa jumlah hanyalah autoionisasi air.
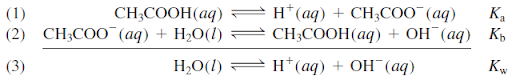
Contoh ini menggambarkan salah satu aturan kesetimbangan
kimia: Ketika dua reaksi ditambahkan untuk memberikan reaksi ketiga, konstanta
kesetimbangan untuk reaksi ketiga adalah produk konstanta kesetimbangan untuk
dua reaksi tambahan. Jadi, untuk setiap pasangan asam-basa konjugasi selalu
benar
Ka Kb = Kw (15.12)
Mengekspresikan Persamaan sebagai
Ka = Kw/Kb Kb = Kw/Ka (15.13)
memungkinkan kita untuk menarik kesimpulan penting: Semakin
kuat asamnya (semakin besar Ka), maka lebih lemah basa konjugasinya (Kb yang
lebih kecil), dan sebaliknya. Kita dapat
menggunakan Persamaan (15.12) untuk menghitung Kb dari basa konjugasi (CH3COO2)
dari CH3COOH sebagai berikut. Kita temukan nilai Ka dari CH3COOH pada Tabel 15.13 dan tuliskan
15.8 Asam Diprotik dan Poliprotik
Perlakuan asam diprotik dan poliprotik lebih terlibat daripada asam monoprotik karena zat ini dapat menghasilkan lebih dari satu ion hidrogen per molekul. Asam-asam ini terionisasi secara bertahap; yaitu, mereka kehilangan satu proton sekaligus. Ekspresi konstan ionisasi dapat ditulis untuk setiap tahap ionisasi. Akibatnya, dua atau lebih persamaan konstanta kesetimbangan harus sering digunakan untuk menghitung konsentrasi spesies dalam larutan asam. Sebagai contoh, untuk asam karbonat, H2CO3 :
Asam fosfat (H3PO4) adalah asam poliprotik dengan tiga hidrogen
yang dapat terionisasi atom:
Kita melihat bahwa asam fosfat adalah asam poliprotik lemah dan konstanta ionisasinya menurun drastis untuk tahap kedua dan ketiga. Dengan demikian, kami dapat memprediksi bahwa, dalam larutan yang mengandung asam fosfat, konsentrasi asam tak terionisasi adalah yang tertinggi, dan satu-satunya spesies lain yang ada dalam konsentrasi yang signifikan adalah H1 dan H2PO24 ion.
15.9 Struktur Molekul dan Kekuatan Asam
Kekuatan asam tergantung pada sejumlah faktor, seperti sifat-sifat pelarut, suhu, dan, tentu saja, struktur molekul asam. Ketika kita membandingkan kekuatan dua asam, kita dapat menghilangkan beberapa variabel dengan mempertimbangkan sifat mereka dalam pelarut yang sama dan pada suhu dan konsentrasi yang sama. Kemudian kita bisa fokus pada struktur asam.
Dua faktor mempengaruhi sejauh mana asam mengalami ionisasi.
Salah satunya adalah kekuatan ikatan H¬X — semakin kuat ikatannya, semakin
sulit bagi HX molekul untuk dipecah dan karenanya asam lebih lemah. Faktor
lainnya adalah polaritas dari ikatan H¬X. Perbedaan elektronegativitas antara
hasil H dan X. dalam ikatan kutub seperti
Jika ikatan sangat terpolarisasi, yaitu jika ada akumulasi besar positif dan muatan negatif pada atom H dan X, HX akan cenderung pecah menjadi H1 dan X2 ion. Jadi tingkat polaritas yang tinggi mencirikan asam yang lebih kuat. Di bawah ini kami akan pertimbangkan salah satu contoh di mana kekuatan ikatan atau polaritas ikatan berperan
Asam karboksilat
Sejauh ini pembahasan difokuskan pada asam anorganik.
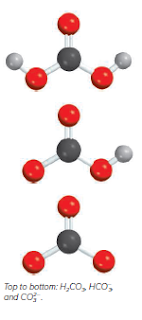
Sekelompok asam organik itu yang juga perlu mendapat perhatian adalah asam
karboksilat, yang struktur Lewisnya bisa dipersembahkan oleh
Di mana R adalah bagian dari molekul asam dan bagian yang
diarsir mewakili karboksil kelompok, ¬COOH. Kekuatan asam karboksilat
bergantung pada sifat R kelompok. Pertimbangkan, misalnya, asam asetat dan asam
kloroasetat:
Kehadiran atom Cl elektronegatif dalam asam kloroasetat
menggeser kerapatan elektron menuju gugus R, sehingga membuat ikatan O¬H lebih
polar. Akibatnya, di sana adalah kecenderungan asam yang lebih besar untuk
terionisasi:
Basa konjugat dari asam karboksilat, disebut anion
karboksilat (RCOO2), dapat menunjukkan resonansi:
Dalam bahasa teori orbital molekul, kami mengaitkan stabilitas anion dengan kemampuannya untuk menyebarkan atau mendelokalisasi kerapatan elektron pada beberapa atom. Lebih besar semakin jauh delokalisasi elektron, semakin stabil anionnya dan semakin besar kecenderungan asam untuk mengalami ionisasi. Jadi, asam benzoat (C6H5COOH, Ka = 6,5 x 10^25) adalah asam yang lebih kuat dari asam asetat karena cincin benzennya memfasilitasi delokalisasi elektron, sehingga anion benzoat (C6H5COO2) adalah lebih stabil dibandingkan dengan anion asetat (CH3COO2).
 |
Peta potensial elektrostatis dari ion asetat. Kerapatan
elektron didistribusikan secara merata antara dua atom O. |
Contoh lain : Asam Hidrohalat dan Asam oksida.
15.10 Sifat Asam-Basa dari Garam
Garam adalah senyawa ionik yang dibentuk oleh reaksi antara asam dan basa. Garam adalah elektrolit kuat yang sepenuhnya terdisosiasi menjadi ion dalam air. Istilah hidrolisis garam menggambarkan reaksi anion atau kation garam, atau keduanya, dengan air. Hidrolisis garam biasanya mempengaruhi pH suatu larutan.
- Kb > Ka. Jika Kb untuk anion lebih besar dari Ka untuk kation, maka larutannyanya haruslah basa karena anion akan terhidrolisis sampai batas yang lebih besar daripada kation. Pada kesetimbangan, akan ada lebih banyak ion OH⁻ daripada ion H⁺.
- Kb < Ka. Sebaliknya, jika Kb untuk anion lebih kecil dari Ka untuk kation, larutannya akan bersifat asam karena hidrolisis kation akan lebih banyak daripada hidrolisis anion.
- Kb ≈ Ka. Jika Ka kira-kira sama dengan Kb, larutannya akan hampir netral.
15.11 Sifat Asam-Basa dari Oksida dan Hidroksida
Oksida dapat diklasifikasikan sebagai asam, basa, atau amfoter. Reaksi asam basa tidak akan lengkap jika kita tidak memeriksa sifat senyawa ini.
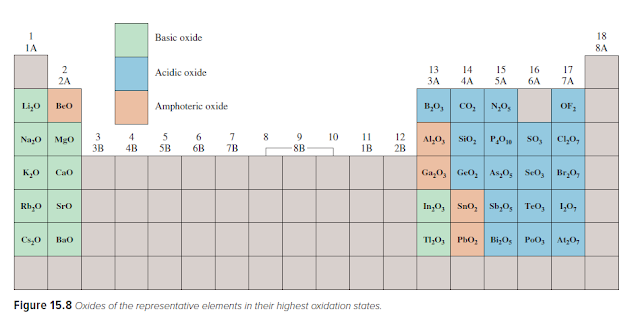
Gambar 15.8 menunjukkan rumus sejumlah oksida dari elemen
perwakilan dalam bilangan oksidasi tertingginya. Perhatikan bahwa semua logam
alkali oksida dan semua alkali oksida logam tanah kecuali BeO bersifat basa.
Berilium oksida dan beberapa oksida logam di Grup 3A dan 4A adalah amfoter. Oksida
non logam yang dioksidasi jumlah unsur yang mewakili tinggi bersifat asam
(misalnya, N2O5, SO3, dan Cl2O7), tetapi yang bilangan oksidasinya rendah (misalnya,
CO dan NO) tidak menunjukkan sifat asam yang dapat diukur. Tidak ada non logam oksida
diketahui memiliki sifat dasar.
Oksida logam dasar bereaksi dengan air membentuk hidroksida logam:
Reaksi antara CO2 dan H2O menjelaskan mengapa ketika air
murni terkena udara (yang mengandung CO2) secara bertahap mencapai pH sekitar
5,5 (Gambar 15.9). Reaksinya antara SO3 dan H2O sebagian besar bertanggung
jawab atas hujan asam (Gambar 15.10).
Reaksi antara oksida asam dan basa dan antara oksida basa
dan asam menyerupai reaksi asam-basa normal di mana produknya adalah garam dan
air:
Seperti yang ditunjukkan Gambar 15.8, aluminium oksida
(Al2O3) bersifat amfoter. Tergantung pada kondisi reaksi, ia dapat berperilaku
sebagai oksida asam atau oksida basa. Untuk Misalnya, Al2O3 bertindak sebagai
basa dengan asam klorida untuk menghasilkan garam (AlCl3) dan air:
Beberapa oksida logam transisi yang logamnya memiliki bilangan
oksidasi tinggi bertindak sebagai oksida asam. Dua contoh yang dikenal adalah mangan
(VII) oksida (Mn2O7) dan chromium (VI) oxide (CrO3), keduanya bereaksi dengan
air menghasilkan asam:
Hidroksida Dasar dan Amfoterik
Kita telah melihat bahwa hidroksida logam alkali dan alkali
tanah [kecuali Be (OH) 2] adalah dasar dalam properti. Hidroksida berikut
adalah amfoter: Be (OH) 2, Al (OH) 3, Sn (OH) 2, Pb (OH) 2, Cr (OH) 3, Cu (OH)
2, Zn (OH) 2, dan Cd (OH) 2. Misalnya aluminium hidroksida bereaksi dengan asam
dan basa:
Semua hidroksida amfoter tidak larut. Sangat menarik bahwa berilium hidroksida, seperti aluminium hidroksida, terlihat amfoterisme:
15.12 Asam dan Basa Lewis
Sejauh ini kita telah membahas sifat asam-basa dalam kerangka teori Brønsted. Untuk berperilaku sebagai basa Brønsted, misalnya, suatu zat harus dapat menerima proton. Dengan definisi ini ion hidroksida dan amonia adalah basa:
Dalam setiap kasus, atom yang menjadi tempat melekatnya proton
memiliki setidaknya satu pasangan elektron yang tidak dibagi. Ini sifat
karakteristik dari OH2, NH3, dan Brønsted lainnya basa menunjukkan definisi
asam dan basa yang lebih umum.
Pada tahun 1932, kimiawan Amerika G. N. Lewis merumuskan
definisi seperti itu. Dia mendefinisikan yang sekarang kita sebut basa Lewis
sebagai zat yang dapat mendonasikan sepasang elektron. SEBUAH Asam Lewis adalah
zat yang dapat menerima sepasang elektron. Misalnya pada protonasi amonia, NH3
bertindak sebagai basa Lewis karena ia menyumbangkan sepasang elektron ke
proton H1, yang bertindak sebagai asam Lewis dengan menerima pasangan elektron.
Seorang Lewis reaksi asam-basa, oleh karena itu, adalah reaksi yang melibatkan
sumbangan sepasang elektron dari satu spesies ke spesies lainnya. Reaksi
seperti itu tidak menghasilkan garam dan air.
Arti penting dari konsep Lewis adalah bahwa ini lebih umum
daripada definisi lainnya. Reaksi asam basa Lewis mencakup banyak reaksi yang
tidak melibatkan Brønsted asam. Perhatikan, misalnya, reaksi antara boron
trifluorida (BF3) dan amoniauntuk membentuk senyawa hasil adisi (Gambar 15.11):

Atom B di BF3 adalah hibridisasi sp2. Yang kosong, tidak
terkendali Orbital 2pz menerima pasangan elektron dari NH3. Jadi BF3 berfungsi
sebagai file asam menurut definisi Lewis, meskipun tidak mengandung zat yang
dapat terionisasi proton. Perhatikan bahwa ikatan kovalen koordinat terbentuk
antara atom B dan N, seperti halnya dalam semua reaksi asam basa Lewis.
Asam Lewis lain yang mengandung boron adalah asam borat.
Asam borat (asam lemah yang digunakan dalam obat pencuci mata) adalah asam okso
dengan struktur sebagai berikut:
Asam borat tidak terionisasi dalam air untuk menghasilkan
ion H1. Reaksinya dengan air adalah
Dalam reaksi asam basa Lewis ini, asam borat menerima
sepasang elektron dari ion hidroksida yang diturunkan dari molekul H2O.
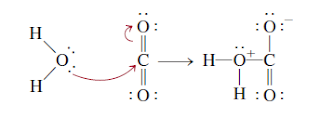
Hidrasi karbondioksida menghasilkan asam karbonat
Dapat dipahami dalam kerangka Lewis sebagai berikut: Langkah
pertama melibatkan donasi dari pasangan elektron mandiri pada atom oksigen
dalam H2O menjadi atom karbon dalam CO2. Sebuah orbital adalah dikosongkan pada
atom C untuk menampung pasangan elektron bebas dengan melepas pasangan elektron
dalam ikatan C¬O pi. Pergeseran elektron ini ditunjukkan oleh panah melengkung.
Oleh karena itu, H2O adalah basa Lewis dan CO2 adalah asam
Lewis. Selanjutnya, proton ditransfer ke atom O yang membawa muatan negatif
untuk membentuk H2CO3.
Contoh lain dari reaksi asam basa Lewis adalah
Penting untuk dicatat bahwa hidrasi ion logam dalam larutan
itu sendiri adalah a Reaksi asam basa Lewis (lihat Gambar 15.7). Jadi, ketika
tembaga (II) sulfat (CuSO4) larut dalam air, setiap ion Cu21 dikaitkan dengan
enam molekul air sebagai Cu (H2O) 621. Dalam hal ini, ion Cu21 bertindak
sebagai asam dan molekul H2O bertindak sebagai basa
 |
| Rangkaian pendeteksi ketinggian air pada suatu tangki (Sumber 15.1) |
- Baterai 12 V
- Resistor 100 ohm
- LED
- Transistor BC548C
- Buzzer
- Alternator
- Lampu
- Relay
- Button
Pada probe level 1, selain LED 1 hidup buzzer juga akan berbunyi. Hal tersebut disebabkan ketika probe level 1 terkena air, maka arus akan mengalir ke baterai ke LED 1 ke kaki kolektor Q1 dan buzzer. Saat arus mengalir ke buzzer, maka akan menimbulkan tekanan pada kumparan dalam buzzer sehingga terjadi perubahan tekanan pada kumparan secara berulang-berulang sehingga buzzer akan menimbulkan suara dan menunjukkan air telah penuh atau level tertinggi. Pada saat bersamaan relay akan terputus karena arus yang mengalir ke LED 4 adalah nol disebabkan karena arus tersebut yang terus berkurang pada level-level sebelumnya dengan juga adanya resistor. Saat relay terputus, maka tidak ada arus yang mengalir ke alternator dan lampu sehingga lampu pun mati yang berarti air sudah penuh.
Download File :
Materi [Disini]
Video [Disini]
Rangkaian [Disini]


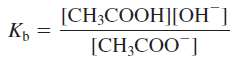




































Tidak ada komentar:
Posting Komentar