Latihan dan Kuis [Bab 15 : 15.7 - 15.12]
Latihan :
15.11
Asam oksalat (H2C2O4) adalah zat beracun yang digunakan
terutama sebagai pemutih dan pembersihan agen (misalnya, untuk melepas cincin
bak mandi). Hitung konsentrasi semua spesies hadir pada kesetimbangan dalam
larutan 0,10 M.
Strategi :
Menentukan konsentrasi kesetimbangan spesies asam diprotic dalam
larutan air lebih banyak terlibat daripada asam monoprotik. Kami mengikuti hal
yang sama prosedur seperti yang digunakan untuk asam monoprotik untuk setiap
tahap. Catatan bahwa basa konjugasi dari tahap pertama ionisasi menjadi asam
untuk ionisasi tahap kedua.
Solusi :
Langkah 1: Spesies utama dalam larutan pada tahap ini adalah
asam tak terionisasi, ion H1, dan basis konjugasi, HC2O24.
Langkah 2: Membiarkan x menjadi konsentrasi kesetimbangan H1
dan HC2O24 ion dalam mol / L, kita meringkasnya :
Langkah 3: Tabel 15.5 memberi kita
Jelas perkiraannya tidak valid. Oleh karena itu, kita harus menyelesaikan kuadrat persamaan
Hasilnya adalah x 5 0,054 M.
Langkah 4: Ketika kesetimbangan untuk tahap pertama ionisasi tercapai, konsentrasi adalah
Selanjutnya kita perhatikan tahap kedua ionisasi.
Langkah 1: Pada tahap ini, spesies utama adalah HC2O24, yang
bertindak sebagai asam di detik tahap ionisasi, H1, dan basa konjugasi C2O4 22.
Langkah 2: Misalkan y adalah konsentrasi kesetimbangan ion H1 dan C2O4 22 dalam mol / L, kita meringkaskan:
Langkah 3: Tabel 15.5 memberi kita
Langkah 4: Pada kesetimbangan,
Memprediksi kekuatan relatif asam okso di masing-masing
kelompok berikut: (a) HClO, HBrO, dan HIO; (b) HNO3 dan HNO2.
Strategi :
Memeriksa struktur molekul. Dalam (a) kedua asam memiliki
kemiripan struktur tetapi hanya berbeda dalam atom pusat (Cl, Br, dan I). Atom
pusat yang mana yang paling elektronegatif? Dalam (b) asam memiliki atom pusat
(N) yang sama tetapi berbeda dalam jumlah atom O. Berapa bilangan oksidasi N di
masing-masing dua asam ini?
Solusi :
(a) Asam-asam ini semuanya memiliki struktur yang sama, dan
semua halogen memiliki struktur yang sama bilangan oksidasi (11). Karena
elektronegativitas menurun dari Cl ke I, atom Cl paling banyak menarik pasangan
elektron yang dibaginya dengan atom O. Akibatnya, ikatan O¬H adalah yang paling
polar di HClO dan paling sedikit di HIO. Dengan demikian, kekuatan asam
berkurang sebagai berikut:
HClO > HBrO >
HIO
(b) Struktur HNO3 dan HNO2 ditunjukkan pada Gambar 15.5.
Karena bilangan oksidasi N adalah 15 di HNO3 dan 13 di HNO2, HNO3 adalah asam
yang lebih kuat dari HNO2.
15.14
Prediksi apakah larutan berikut ini bersifat asam, basa,
atau hampir netral: (a) NH4I, (b) NaNO2, (c) FeCl3, (d) NH4F.
Strategi:
Dalam memutuskan apakah suatu garam akan mengalami
hidrolisis, tanyakan pada diri Anda hal-hal berikut ini pertanyaan: Apakah
kation merupakan ion logam bermuatan tinggi atau ion amonium? Apakah anion itu basa
konjugasi dari asam lemah? Jika ya untuk kedua pertanyaan tersebut, maka
hidrolisis akan terjadi. Dalam kasus di mana kation dan anion bereaksi dengan air,
pH larutan akan bergantung besaran relatif Ka untuk kation dan Kb untuk anion
(lihat Tabel 15.7).
Solusi :
Pertama-tama kita memecah garam menjadi komponen kation dan
anionnya, lalu periksa kemungkinan reaksi setiap ion dengan air.
(a)
Kationnya adalah NH4 1, yang akan terhidrolisis
menghasilkan NH3 dan H1. Anion I2 adalah basa konjugasi dari asam kuat HI. Oleh
karena itu, I2 tidak akan menghidrolisis dan larutan bersifat asam.
(b)
Kation Na1 tidak terhidrolisis. NO2 2 adalah
basa konjugasi dari yang lemah asam HNO2 dan akan terhidrolisis menghasilkan
HNO2 dan OH2. Solusinya akan menjadi dasar.
(c)
Fe31 adalah ion logam kecil bermuatan tinggi dan
terhidrolisis menghasilkan ion H1. Cl2 tidak terhidrolisis. Akibatnya, larutan
menjadi asam.
(d)
Baik ion NH4 1 dan F2 akan terhidrolisis. Dari
Tabel 15.3 dan 15.4 kita melihat itu Ka dari NH4 1 (5,6 3 10210) lebih besar
dari Kb untuk F2 (1,4 3 10211). Karena itu, solusinya akan menjadi asam.
KUIS :
1. Identifikasi pasangan asam-basa konjugasi untuk reaksi
Jawab :
Pasangan asam basa konjugasi adalah
H₂O dan OH⁻ atau CN⁻ dan HCN
B + H₂O => BH + OH⁻
Sekarang dapat dicari konsentrasi hidroksida (x) menggunakan rumus Kb yang diberikan. Jangan lupa untuk menyiapkan persamaan sebagai produk daripada reaktan.

Dengan menyusun ulang persamaan ini kita akan mendapatkan
Konsentrasi OH tidak berkurang, jadi x harus positif. Nilai kosentrasi adalah 9,1 × 10-4
Cari nilai pH larutan.
Jadi, nilai pH larutan adalah 10,96.
3. Larutan asam monoprotik 0,040 M, 14% nya terionisasi. Htiunglah konstanta ionisasi asam ?
\
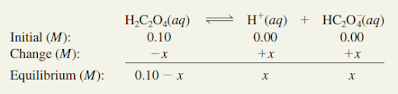



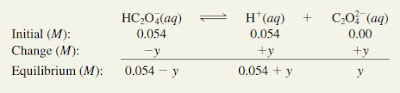


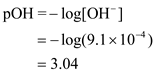






Tidak ada komentar:
Posting Komentar