LATIHAN :
3.47
(Rumus Empiris)
Hitung massa dalam gram yodium (I2) yang
akan bereaksi sempurna dengan 20,4 g aluminium (Al) membentuk aluminium iodida
(AII3)…
A.
287.655 g
B.
286.655 g
C.
287.675 g
D. 280.395 g
E.
280.655 g
Jawab :
1. Tulis reaksi : 2Al + 3I2 → 2AlI3
2 .
Tentukan mol :
Ar Al = 27
mol Al = massa / Ar
= 20,4 / 27
= 0,755
mol I2 =
(koefisien I2 / koefisien Al) x mol Al
= (3/2) x 0,755
= 1,1325 mol
3.Tentukan massa I2
:
Mr I2 =
254
massa I2 = mol x Mr
= 1,1325 x 254
= 287,655 gr (A)
3.65 (Reaktan dan Produk)
Pertimbangkan pembakaran karbon monoksida (CO) dalam
gas oksigen:
2CO (g) + O2
(g) → 2CO2 (g)
Dimulai dengan 3,60 mol CO, berapa jumlah mol CO2
yang dihasilkan jika ada cukup gas oksigen untuk bereaksi dengan semua CO…
A. 1.8 mol
B. 7.2 mol
C. 3.6 mol
D. 1.3 mol
E.
9.8 mol
Jawab :
Jumlah mol =
koef CO2/koef CO x mol CO
=
2/2 x 3,60
=
3,6 mol (C)
3.86 (Pereaksi pembatas)
Perhatikan reaksi dibawah ini
MnO2 + 4HCl → MnCl2 + Cl2 +2H2O
Jika 0,86
mol MnO2 bereaksi dengan 48,2 g HCl. Pereaksi mana yang habis
bereaksi terlebih dahulu? Berapa gram Cl2 yang akan dihasilkan?
A. MnO2 (Cl2 = 23,9
g)
B. MnO2 (Cl2 = 23,33 g)
C. MnO2 (Cl2 = 23,43 g)
D. HCl (Cl2 =
23,43 g)
E. HCl (Cl2 =
23,33 g)
Jawab :
MnO2 : 0,86 mol
massa HCl : 48,2 gram
pereaksi yg habis bereaksi :
........ ?
Massa Cl2 yg terbentuk :
...... g ?
Langkah 1 : Buat Reaksi terlebih dahulu.
Reaksi telah dibuat maka perhatikan baik baik reaksi tersebut.
Langkah 2 : Tentukan mol HCl.
mol = massa / Mr
Mr HCl = 1
+ 35,5 = 36,5
g/mol
mol HCl = m. HCl : Mr HCl
mol HCl = 48,2 g / 36,5 g/mol
Mol HCl = 1,32 mol
Langkah 3 : Tentukan pereaksi pembatasnya
dimana jumlah mol yg terkecil dianggap sebagai pereaksi pembatas. Caranya mol
MnO2 dan HCl dibagi dengan koefisien masing masing reaksi.
Perhatikan koefisien reaksi di soalmu.
MnO2 + 4HCl
mol MnO2 / K. MnO2
= 0,86 / 1
= 0,86
mol HCl / K. HCl
= 1,32 / 4
= 0,33
Dari kedua data tersebut dapat disimpulkan bahwa
pereaksi pembatasnya adalah HCl karena nilainya lebih kecil dari data MnO2
Langkah 4 : Tentukan reaksi mula mula (m),
bereaksi (b), dan sisa (s).
Reaksi :
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
m : 0,86 mol 1,32 mol
b : (1/4) x
1,32mol 1,32 mol (1/4) x 1,32 mol
0,33 mol 0,33 mol
(-1,32)
s : 0,53 mol habis 0,33
mol
Dari data diatas terdapat sisa 0,53 mol MnO2 sehingga senyawa
yg habis bereaksi adalah HCl karena TIDAK ADA SISA MOL.
Langkah 5 : Tentukan massa Cl2 yg terbentuk.
Dari data sebelum terdapat 0,33 mol Cl2 yg terbentuk sehingga massa Cl2 dapat
ditentukan.
Ar Cl2 = 35,5(2)
= 71 g/mol
mol Cl2 = m. Cl2 / Ar
Cl2
massa Cl2 = mol Cl2 x Ar Cl2
= 0,33 mol x 71 g/mol
= 23,43 gram
Jadi, pereaksi yg habis bereaksi dahulu adalah HCl dan
terbentuk 23,43 gram Cl2 (D)
3.94 (Hasil Reaksi)
Disulfida diklorida
(S2Cl2) digunakan dalam vulkanisasi karet, suatu proses
yang mencegah selipnya molekul karet melewati satu sama lain saat diregangkan.
Ini dipersiapkan dengan memanaskan belerang dalam atmosfer klorin:
S8
(l) + 4Cl2 (g) → 4S2Cl2
(l)
Berapa hasil
teoritis S2Cl2 dalam gram ketika 4,06 g S8
dipanaskan dengan 6,24 g Cl2? Jika hasil sebenarnya dari S2Cl2
adalah 6,55 g, berapa persen hasil?
A.
8.64 g dan
75,81%
B.
2.16 g dan 30.32%
C.
11.88 g dan 55.13%
D.
3.24 g dan 20.21%
E.
6.84 g dan 95.76%
Jawab :
Langkah 1 : Tulis reaksi kimia dan perhatikan
reaksi itu baik-baik
S8 +
4Cl2 → 4S2Cl2
Langkah 2 : Tentukan mol pada masing-masing zat
Mol S8 = gram/Mr
= 4,06/256
= 0,016 mol
Mol
Cl2 = gram/Mr
= 6,24/71
= 0,088 mol
Langkah 3 : Tentukan reaksi mula-mula (M), bereaksi (B), dan sisa (S)
S8 +
4Cl2 → 4S2Cl2
M 0,016 0,088
B 0,016 0,064 0,064
S 0 0,024
0,064
Langkah 4 : Tentukan nilai secara teoritis serta presentasenya
Hasil teoritis S2Cl2 = n x Mr
= 0,064 x 135
= 8,64 gram
% S2Cl2 = 6,55/8,64 x 100%
= 75,810185%
= 75,81%
Jadi, hasil teoritis dan presentase dari S2Cl2
adalah 8.64 g dan 75.81% (A)
KUIS :
Chapter - 1
1)
Brom adalah cairan berwarna coklat kemerahan. Hitung massa
jenisnya (dalam g / mL) jika 586 g bahan menempati 188 mL
A.
3.15 g/ml
B.
3.11 g/ml
C.
3.12 g/ml
D.
3.16 g/ml
E.
3.18 g/ml
Jawab :
Massa Jenis = massa/volume
=
586/188
=
3.117 g/ml
=
3.12 g/ml (C)
2)
Simbol kimia untuk unsur Stronsium adalah...
A. St
B. Sn
C. S
D. Si
E. Sr
Chapter - 2
1)
Hitung jumlah neutron dalam 239 94Pu…
A.
239
B.
94
C.
333
D.
145
E.
155
Jawab :
Neutron = nomor
massa – proton
= 239 –
94
= 145 (D)
2)
Rumus
kimia dari magnesium nitrida adalah...
A.
Mg2N6
B.
Mg3N2
C.
Mg2N3
D.
Mg6N4
E.
Mg4N2
Jawab :
Mg :
golongan IIA, membentuk ion +2 = Mg2+
N :
golongan VA, membentuk ion -3 = N3-
Sehingga
rumus magnesium dengan mengkali silang
pangkat muatan ion → Mg3N2
(B)
Chapter - 4
1)
Terdapat
suatu larutan HCl 1 M. Hitunglah volome yang dibutuhkan bila ingin membuat larutan HCl 0,1 M
sebanyak 100 ml!
A. 20 mL
B. 100 mL
C. 50 mL
D. 120 mL
E. 10 mL
Jawab :
Ket : [HCl] encer = 0,1 N
V HCl encer = 100 mL
[HCl]
pekat = 1 N
Untuk
menghitung volume kita bisa menggunakan rumus perbandingan mol
V₁ × M₁ = V₂ ×
M₂
V₁ × 1 N = 100 mL ×
0,1 N
V₁ × 1 N = 10 N.mL
V₁ = 10 N.mL / 1 N
= 10 mL (E)
2)
Zat H2O dan KCl merupakan jenis elektrolit…
A. Lemah dan kuat
B. Lemah dan lemah
C. Kuat dan kuat
D. Non elektrolit dan kuat
E. Lemah dan non elektrolit
Chapter - 5
1)
3,50 mol NH₃
menempati 5,20 L pada 47°C. Berapakah tekanan gas (dalam atm) ika dihitung
menggunakan persamaan gas ideal?
A.
17.7 atm
B.
17.6 atm
C.
2.59 atm
D.
25.9 atm
E.
26 atm
Jawab :
Ket : n = 3,50 mol
V = 5,20 L
T = (47 + 273) K = 320 K
R = 0,0821 L . atm/K . mol
P = n R T
/ v
= 3.50 x 0.0821 x
320 / 5.20
= 17.7 atm (A)
2)
Jika 2,7 gram aluminium
(Ar Al =27) dilarutkan dalam 500 ml larutan H2SO4 menghaslikan
aluminium sulfat dan gas hidrogen. Maka molaritas H2SO4…
A. 1.5 M
B. 15 M
C. 0.15 M
D. 0.3 M
E. 0.1 M
Jawab :
Ket
: Massa Al = 2.7 g
Mol
Al = massa/Ar
=
2.7/27
=
0.1 mol
V H2SO4 = 500 mL
= 0.5 L
Persamaan
reaksi : 2 Al + 3 H2SO4 → Al2 (SO4)3 + 3H2
Mol H2SO4 =
koef H2SO4/koef Al x mol Al
= 3/2 x 0,1
= 0,15 mol
Molaritas
H2SO4 = n / V
=
0.15 / 0.5
= 0.3 M (D)
Chapter - 6
1)
Pengertian Entalphi (∆E) adalah …
A.
Perubahan massa
B.
Perubahan volume
C.
Perubahan energy dalam
D.
Perubahan mol
E.
Perubahan suhu
2)
Sebuah gas mengembang dan melakukan kerja P-V di sekitarnya sebesar 325 J. Pada saat yang sama, ia menyerap 127 J panas dari sekitarnya. Hitung perubahan energi gas.
A. -190 j
B. -198 j
C. 198 j
D. 452 j
E. -452 j
Jawab :
∆E = perubahan energi dalam
jika:
energi menyerap kalor maka q(+)
energi melepas kalor maka q(-)
energi melakukan kerja maka W(-)
energi menerima kerja maka W(+)
suatu gas melakukan kerja maka W(-) dan menyerap kalor maka q(+)
∆E = q+W
=127 J +(-325 J)
= -198 J (B)
Chapter - 7
1)
Partikel
dasar dalam atom terdiri dari . . . .
A.
Proton, elektron, dan positron
B.
Proton, neutron, dan nukleon
C.
Proton, elektron, dan neutron
D. Positron, nukelon, dan
elektron
E.
Neutron, nukleon, dan electron
Jawab :
Partikel
dasar dalam atom ada 3 yaitu :
- Proton
= muatannnya +
- Elektron
= Muatannnya –
- Neutron
= Tidak bermuatan = muatannnya netral
(C)
2)
Unsur
X mempunyai 10 proton dan 12 neutron, sedangkan unsur Y mempunyai nomor massa
23 dan nomor atom 11. Kedua atom tersebut merupakan . . . .
A.
Isotop
B.
Isobar
C.
Isoton
D. Isokhor
E.
Isomer
Jawab :
Pertama
kilat dulu penertian dari istilah diatas
- Isotop
= Atom sama, Nomor Atom sama, Nomor Massa Berbeda
- Isobar
= Atom berbeda, Nomor Atom Berbeda, Nomor Massa sama
- Isoton
= Atom berbeda, Nomor atom dan nomor massa berbeda, jumlah neutron sama
- Isokhor
= istilah dalam termodinamika jika volume system tetap
- Isomer
= senyawa yang memiliki rumus molekul sama tetapi rumus struktur, gugus
fungsi dan geometri berbeda.
Option
C dan D tidak ada hubungannya dengan soal.
Atom X memiliki : p = 10
n = 12
Nomor
atom = jumlah proton = 10
Jumlah
neutron = 12
Nomor
massa = Jumlah proton + Jumlah neutro
= 10 + 12
= 22
Atom Y memiliki :
Nomor
massa = 23
Nomor
atom = 11 = jumlah proton
Jumlah neutron (n) = Nomor massa – p
= 23 – 11
= 12
Atom X dan Y memiliki jumlah neutron yang sama maka X dan Y adalah isoton (C)
Chapter - 8
1)
Harga keempat bilangan kuantum elektron terakhir dari atom 16S
adalah…
A. n
= 2, l = 0, m = 0, s = -1/2
B. n
= 3, l = 1, m = -1, s = -1/2
C. n
= 3, l = 1, m = 0, s = -1/2
D. n
= 3, l = 1, m = 0, s = +1/2
E. n
= 3, l = 1, m = +1, s = +1/2
Jawab :
Menentukan harga bilangan kuantum
Elektron
terakhir berada pada orbital 3s 3p
Untuk orbital
3s :
- n = 3, l = 0, m = 0, s = +1/2
- n = 3, l = 0, m = 0, s = -1/2
Untuk orbital
3p
- n = 3, l = 1, m = +1, s = +1/2
- n = 3, l = 1, m = 0, s = +1/2
- n = 3, l = 1, m = -1, s = +1/2
- n = 3, l = 1, m = -1, s = -1/2
(B)
2)
Unsur 16T
dalam sistem periodik unsur terletak pada golongan dan periode berturut-turut…
A.
IVA, periode 3
B.
VA, periode 2
C.
VIA, periode 3
D. VIIA, periode 3
E.
IVB, periode 2
Jawab
:
menentukan
letak unsur
Menurut
atom Bohr, unsur T memiliki 3 kulit dan 6 elektron valensi maka T terletak pada
periode 3 golongan VIA. Hal ini jelas terlihat dari konfigurasi elektronnya.
(C)
Chapter - 9
1)
Jenis ikatan yang menggabungkan antara Al dan Cl pada produk reaksi : AlCl3 + Cl- → AlCl-4...
A.
Ikatan ion
B.
Ikatan kovalen tunggal
C.
Ikatan ion polar
D.
Ikatan kovalen koordinat
E.
Ikatan non polar
Jawab :
Berdasarkan struktur lewis, jenis ikatan yang menggabungkan
Al dan Cl dalam produk adalah ikatn kovalen koordinat. (D)
2)
Entalpi ikatan F2( g) adalah 156,9 kJ /
mol.Hitunglah entalpi pembentukan untuk F(g)
A.
78
kJ/mol
B.
79.1 kJ/mol
C.
77.5 kJ/mol
D.
75.8 kJ/mol
E.
78.5 kJ/mol
Jawab :
F2 (g) → 2F (g) ∆H = 156.9 kJ/mol
∆H = 2 ∆Hf (F) - ∆Hf (F2)
156.9 = 2 ∆Hf
(F) – (1) (0)
∆Hf (F) = 156.9 / 2
= 78.5 kJ/mol (E)
Chapter - 10
1)
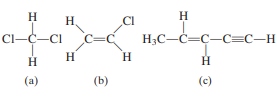
Berapa banyak ikatan sigma dan ikatan pi yang
ada di masing-masing molekul berikut?
A.
a(4,3)b(5,1)c(7,0)
B.
a(4,0)b(5,1)c(7,0)
C.
a(4,3)b(5,1)c(7,2)
D.
a(4,0)b(5,1)c(7,3)
E.
a(4,3)b(5,1)c(7,3)
Jawab :
Perhatikan bahwa dalam menghitung ikatan sigma
dan ikatan pi, semua ikatan tunggal adalah ikatan sigma, dan untuk ikatan
rangkap tiga ada satu ikatan sigma dan dua ikatan pi.
Jadi,
(a) 4 ikatan sigma dan 0 ikatan pi.
(b) 5 ikatan sigma dan 1 ikatan pi.
(c) 7 ikatan sigma dan 3 ikatan pi.
(D)
2)
Berikut
ini data titik didih beberapa senyawa hidrida.
- HI = -35oC
- HF = 19,4oC
- HBr = -67oC
- HCl = -84oC
- HCN = -26oC
Di
antara senyawa-senyawa pada data tersebut yang memiliki ikatan hidrogen paling
kuat adalah …
A.
HCN
B.
HI
C.
HF
D.
HBr
E. HCl
Jawab :
Berdasarkan data titik didih terlihat bahwa senyawa yang memiliki titik didih terbesar adalah HF. Pada molekul HF ujung molekul pada atom H lebih bermuatan positif dan ujung molekul pada atom F lebih bermuatan negatif. Jadi, antara atom H pada molekul pertama dengan atom F pada molekul berikutnya terjadi gaya tarik-menarik yang cukup kuat, yang disebut dengan ikatan Hidrogen.
(C)
Chapter - 11
1)
Berapa
banyak kalor yang dibutuhkan untuk mengubah 74,6 g air menjadi uap pada suhu 100 ° C…
A.
7.44 kkal
B.
7.46 kkal
C.
7.66 kkal
D.
7.51 kkal
E. 7.64 kkal
Jawab
:
Q = m c ΔT
= 74,6 gr × 1 k/g°C × 100°C
= 7,46 kkal (B)
2)
Antarmolekul
diatomik dapat membentuk gaya antarmolekul karena adanya gaya London. Sesuai
dengan faktor-faktor yang mempengaruhi gaya London, antarmolekul diatomik
berikut yang memiliki gaya van der Waals paling kuat adalah ….
A.
H2 dan
N2
B.
N2 dan
Cl2
C.
H2 dan
Cl2
D.
N2 dan
O2
E.
Cl2 dan
O2
Jawab :
H2 jumlah
elektron 2, N2 jumlah elektron 14, O2 jumlah
elektron 16, Cl2 jumlah elektron 34, berdasarkan data tersebut
dapat disimpulkan bahwa titik didih dipengaruhi oleh jumlah elektron.
Semakin
banyak jumlah elektron maka gaya tarik-menarik molekul dipol sesaat semakin
besar sehingga ikatannya semakin kuat. Mudah tidaknya suatu molekul membentuk
dipol sesaat dinamakan polarisabilitas.
(E)
Chapter - 12
1)
Sifat
koligatif larutan adalah sifat yang bergantung pada ….
A.
Jenis zat terlarut
B.
Jenis zat pelarut
C.
Jumlah zat pelarut
D.
Jumlah zat terlarut
E. Konsentrasi larutan
2)
Larutan fruktosa dengan konsentrasi 1,476 M mempunyai massa
jenis 1,1 g/ml. Berapa kemolalan larutan adalah …. (Mr fruktosa = 180)
A.
17.7
mol/kg
B.
0.17
mol/kg
C.
1.77
mol/kg
D.
17
mol/kg
E.
17.1
mol/kg
Jawab :
Ket : Perhitungan dalam 1 L/ 1000 mL laruran
Mol fruktosa = 1.476 mol
Massa
jenis larutan = 1.1 g/ml
Mr fruktosa
= 180
Massa larutan =
massa jenis x volume
=
1.1 x 1000
=
1100 g
Massa fruktosa =
n x Mr
=
1.476 x 180
=
265.6 g
Massa air (w) =
w larutan – w fruktosa
=
1100 – 265.6
=
834.4 g
Kemolalan =
n fruktosa / w air x 1000
=
1.476 / 834.4 x 1000
=
1.77 mol/kg (C)





Tidak ada komentar:
Posting Komentar